OOS,英文全称“Out of specification”,中文名“检验结果超标”,制药行业术语,国际、国内《药品生产质量管理规范》已实施很多年,但在兽药上来说,OOS仅仅是个刚开蒙的孩子罢了。
《兽药生产质量管理规范(2020年修订)》,首次引入了兽药OOS概念,回顾这几年的实施情况,笔者感觉受益良多,既增加了感觉及QC(质量控制)团队的检验分析能力,提升了管理,又避免了生产车间质量浪费。

以复方阿莫西林粉为例来说明启动OOS前后的差异以及启动后的受益情况。
复方阿莫西林粉,2022年3月份之前,该产品虽然进行了工艺验证,但在检验过程中经常会出现克拉维酸含量偏高或是检验结果不均等问题,产品一次检验合格率不足70%,每个月笔者公司都因为该产品对生产车间进行考核,每次提到该产品笔者公司员工都唉声叹气,将原因归结为物料不稳定、混合时间不足或超时、生产过程湿度不符合要求等等。
2022年4月份,笔者公司按照新版兽药GMP进行了验收并顺利通过,恰逢该月连续排产6批复方阿莫西林粉,结果2批检验结果克拉维酸偏高,不符合规定,按照新版兽药GMP要求,化验室当即开展了OOS调查,调查过程如下。
第一,2022年4月份6批复方阿莫西林粉半成品检验结果如表1。
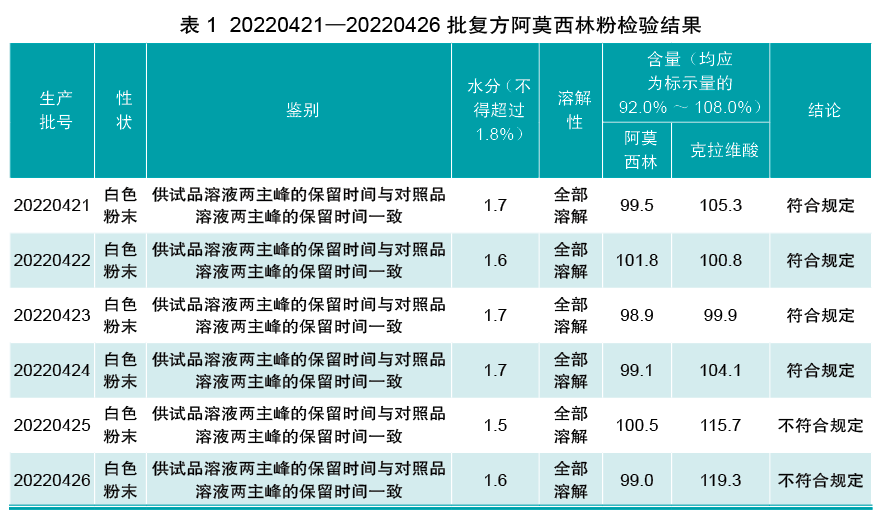
第二,化验室OOS调查。1)人。20220425、20220426批复方阿莫西林粉QC人员未变动,且检验操作过程与本月生产的其他4批一致;2)机。高效液相色谱维护保养正常,使用期间无异常,且期间穿插检验的其他品种检验均符合规定;3)料。半成品来源于QA取样,阿莫西林对照品经查未发现异常,克拉维酸对照品20220421—20220424批为同一批对照品,20220425、20220426为另一批新购对照品;4)法。检验标准操作规程未发生变更;5)环境。检验实验室环境温度、湿度及其他条件均符合规定。
经查,25、26批使用的克拉维酸对照品为新购对照,使用前未按规定进行确认,后经追溯该批对照品运输过程未按规定进行储藏且运输时间过长,致使该批对照品含量低于其标识含量,导致半成品检验结果超标,启用确认后的合格对照品重新检测25、26批半成品克拉维酸含量分别为100.8%和102.0%,均符合规定。
2022年4月至今,笔者公司化验室持续开展了多次OOS调查,公司的受益不仅仅是复方阿莫西林粉一次合格率提升至97.2%,其他产品一次合格率也都得到了相应提升,QC复测率降低5.7%,车间二次混合(配液)率降低4.3%,既保障了出厂产品品质,又避免了质量浪费,同时提升了QC团队的管理能力。(作者:吕晓阳 保定冀中药业有限公司)
















