自1995年我国暴发猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)疫情以来,该病始终伴随我国养猪业的发展。尤其是2006年暴发的高致病性猪繁殖与呼吸综合征(HP-PRRS)疫情,给我国养猪业造成了巨大的经济损失,此后PRRS成为影响我国养猪业发展的主要疫病之一。2006—2014年,我国猪群中流行的PRRSV主要为高致病性PRRSV(HP-PRRSV)以及针对该毒株的疫苗株,但2014年以后我国许多省份发现的类NADC30 PRRSV又导致了PRRS疫情的波动发生。
对于PRRSV等主要动物疫病病毒的分子生物学检测,除了检测试剂盒的特异性、敏感性和重复性等因素对检测结果影响较大外,病毒RNA提取也是关键环节之一,RNA的提取效率和质量直接影响最终检测结果的准确性。随着高分子材料的快速发展,RNA提取技术已由传统的液相系统分离技术转变为固相载体吸附技术,如膜吸附技术、磁珠吸附技术等,其中膜吸附技术(离心柱提取法)已被普遍应用。该方法提取率较高且质量稳定,但至今未实现高通量自动化操作。磁珠吸附技术(纳米磁珠法)提取效率高,且可通过仪器自动化批量提取,操作简单,目前已被众多实验室采用。
以往试剂比对工作中,往往以质粒、病毒分离株、已知浓度临床样品等作为标准品,但在稳定性和均匀性上均有所局限,难以保证比对试验科学准确。本研究使用国家标准物质“猪繁殖与呼吸综合征病毒美洲经典株核酸标准物质”作为提取样本。该标准物质具有稳定、均匀和准确等特征,是定性和定量测量分析的一种标杆,可应用于检测活动的校准、评估和质量控制,从而为评估核酸提取试剂盒的提取效率提供了支撑。
为优选出提取效率高的核酸提取试剂盒,本研究选择5种试剂盒分别提取不同浓度的PRRSV核酸标准物质,使用荧光RT-PCR和数字RT-PCR方法进行检测,通过Ct值和核酸含量评价病毒RNA提取效率。
材料与方法
标准物质
猪繁殖与呼吸综合征病毒美洲经典株核酸标准物质:编号GBW(E)090930,由中国动物疫病预防控制中心研制,量值为(2.06±0.15)×104 copies/μL,于-20 ℃保存备用。
试剂与仪器
核酸提取试剂盒。5种RNA病毒提取试剂盒,其中试剂盒A(进口)、B(国产)、C(国产)为磁珠法机提,试剂盒D(进口)、E(国产)为柱式手提,分别购自各品牌供应商。
主要试剂。PRRSV通用型实时荧光RT-PCR检测试剂盒,购自北京世纪元亨动物防疫技术有限公司;One-step RT-ddPCR Kit for Probes,购自伯乐公司。
比较方法
RNA提取。对试剂盒D和E,采用离心柱吸附技术,按照试剂盒说明书,手动提取病毒RNA;对其余3种试剂盒,均采用磁珠法,按照试剂盒说明书,运用相应核酸提取仪,自动提取病毒RNA。分别使用上述5种试剂盒对2种浓度的PRRSV核酸标准物质做3次平行提取,共获得30份提取产物。
荧光定量RT-PCR方法。采用PRRSV荧光RT-PCR检测方法,按照试剂盒说明书对30份提取产物分别进行反转录扩增。通过Ct值比较不同试剂盒的RNA提取效率。
数字RT-PCR方法。采用微滴式PRRSV通用型数字RT-PCR检测方法,对30份提取产物分别进行反转录扩增。通过核酸含量(copies/μL)比较不同试剂盒的RNA提取效率。
不同基质对核酸提取效率的影响。选用TE、抗凝血、血清、血浆、扁桃体、淋巴结、肺脏、精液、唾液、饲料等多种常见基质,探究不同基质对核酸提取效率的影响,其中对组织采取匀浆处理,TE、血清等直接使用。在上述基质中,5倍稀释PRRSV标准物质后,分别提取3次,通过荧光RT-PCR和数字RT-PCR方法进行扩增,比较试剂盒对不同基质中病毒RNA的提取效率。
结果与分析
荧光RT-PCR方法比较提取效果
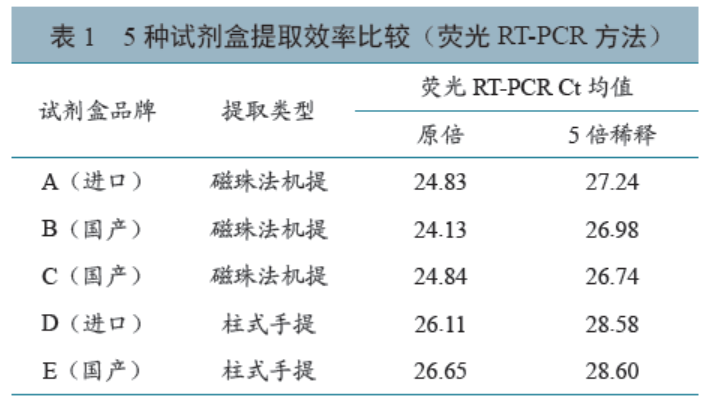
3种磁珠法机提试剂盒的Ct平均值明显低于柱式手提试剂盒,提取较高浓度核酸标准物质时(2×104 copies/μL),扩增后Ct值从低到高排序为B<A<C<D<E,其中试剂盒A、C提取的样本扩增后Ct值相近;提取较低浓度核酸标准物质时(4×103 copies/μL),Ct值从低到高排序为C<B<A<D<E,其中试剂盒B和C提取的样本扩增后Ct值相近。详见表1。
微滴式数字RT-PCR方法比较提取效果
试剂盒B、C提取的样本扩增后产物浓度相对较高,核酸提取试剂盒回收率可达98.50%以上。提取较高浓度核酸标准物质(2×104 copies/μL)和较低浓度核酸标准物质(4×103 copies/μL)时,核酸提取试剂盒回收率从高到低排序均为C>B>A>D>E。详见表2。
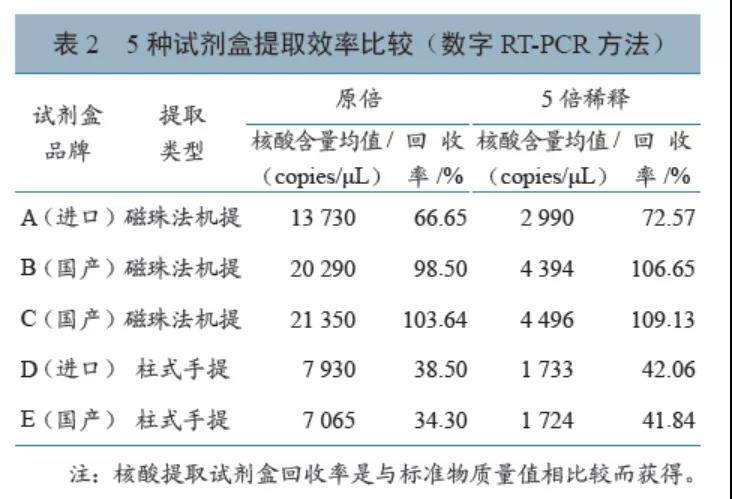
试剂盒D、E为手动提取,操作相对复杂,耗时长。A、B、C等3种试剂盒均可通过仪器自动化或半自动化提取,操作相对简便,提取RNA耗时较短。但试剂盒C必须使用配套仪器提取,使用存在一定限制。
不同基质对核酸提取效率的影响
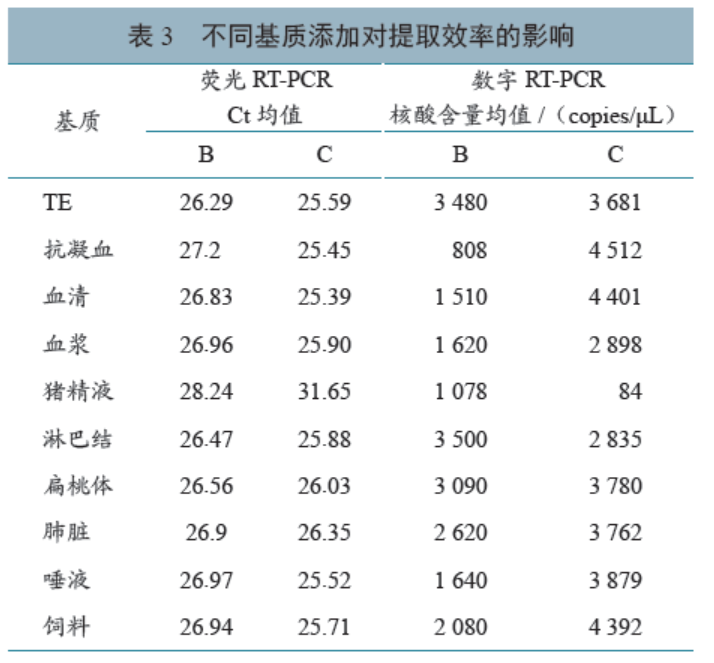
综合2.1~2.3结果分析,本研究选择试剂盒B、C,分析不同基质对试剂盒提取效率的影响。结果显示,对于试剂盒B,抗凝血对提取效率影响最大,精液次之,淋巴结、TE、扁桃体等基质影响较小;对于试剂盒C,精液对提取效率影响较大,其他基质影响较小;两种试剂盒相比较,提取抗凝血、血清、饲料、唾液、扁桃体、肺脏、TE、血浆中的PRRSV RNA时,试剂盒C的提取效率均高于试剂盒B,提取淋巴结中的PRRSV RNA时,试剂盒B的提取效率略高于试剂盒C,提取精液中的PRRSV RNA时,试剂盒B的提取效率高于试剂盒C。详见表3。
讨论
本研究选取了2种柱式核酸提取试剂盒、3种磁珠核酸提取试剂盒进行分析,发现5种核酸提取试剂盒均能有效提取PRRSV RNA,其中磁珠提取试剂盒的提取效率要显著高于柱式提取。提取较低浓度核酸标准物质时,3种磁珠提取试剂盒回收率平均值为96.12%,柱式提取试剂盒回收率平均值仅为41.95%。其原因除了柱式提取本身结合能力有限之外,还可能是因为PRRSV作为RNA病毒,RNA分子不稳定,易分解,加之RNase无处不在,而柱式核酸提取试剂盒在实际操作中需要反复开盖、加液和离心,操作更复杂,造成RNA分解的概率更高。两种方法相比较,磁珠提取可实现高通量、自动化,更适用于高通量检测,但试剂和提取仪器成本较高;而柱式核酸提取试剂盒成本低、方法可靠,适合少量样品的核酸提取。因此对于两者的选取,需要根据实验室条件、样品数量和任务紧迫性等多种因素综合考虑。
在PRRS诊断方法中,核酸扩增技术更为简便、快捷和准确,于感染后24 h即可检测到病毒,对于PRRS的早期诊断意义重大。但通过核酸扩增检测PRRSV试验过程比较复杂,涉及病料样品的RNA提取、反转录、PCR扩增等多步操作。此外,样品中核酸的不均匀性和样本基质的多样性,给标准化带来了一定的困难。PRRSV核酸标准物质的成功研制,可以实现对核酸提取、反转录、PCR扩增3个环节的质量控制,在实验室检测过程中具有很好的适用性,对实验室的人员操作、仪器校准等内部质量体系控制和推动PRRSV核酸检测标准化都起着不可或缺的作用。
数字PCR方法可实现绝对定量,更适用于检测方法和试剂比对。在本研究中,通过荧光PCR方法扩增,试剂盒A、B、C的提取效率均较高,无明显差异;而通过数字PCR方法,试剂盒B和C的提取效率分别比试剂盒A高1.7倍和1.8倍,更精确体现了试剂盒提取效率的差异。荧光RT-PCR在灵敏度和敏感性特异性上仍存在一定的局限性,只能实现定性和半定量检测,无法对病毒核酸进行精确定量。而微滴式数字化PCR通过微滴发生器将每个样品分成20000个均匀的纳升级微滴,每个微滴都作为一个独立的PCR反应器进行检测,可计算给出待检靶分子的浓度或拷贝数,准确度和灵敏度更佳,可更精确地比较提取试剂盒的效率差异。
通过基质稀释标准物质,能够在一定程度上反映不同基质对PRRSV核酸提取的影响,但不能完全模拟感染动物组织中的PRRSV核酸提取情况,仅可为实验室人员提取不同基质中PRRSV核酸时选择试剂盒提供参考。
5种试剂盒均能有效提取PRRSV RNA,其中磁珠法的提取效率高于柱式法;试剂盒B和C对PRRSV RNA的提取效率较高;基质会对提取效率造成影响,精液和抗凝血对试剂盒提取效率的影响较大。综上,试剂盒B、C均可适用于PRRSV临床样品的核酸提取。实际操作中,应根据实验室条件、样品类型、样品数量和时间要求等因素,选取应用合适的提取试剂盒。
















